島根大学:統合腎疾患制御研究・開発センター細胞外基質代謝・血管新生制御部門

細胞外基質代謝・血管新生制御部門では、主に糖尿病、代謝異常、高血圧、老化に関連して生じる腎臓の機能障害に注目し、その病態の解明に取り組んでいます。
糖尿病関連腎臓病の病態解明
糖尿病関連腎臓病は、糖尿病に本質的に生じうる糖尿病性腎症と、治療の影響も含めた糖尿病やその合併症に関連して誘導される多様な病態を総括した概念です。この概念の定義化には、金﨑が主導的な役割を果たしました。
典型的な糖尿病性腎症と非典型的な糖尿病関連腎臓病では、血管新生異常や細胞外基質代謝における病態が大きく異なる可能性があります。また、治療の影響については、糖尿病や高血圧に対して長期的に用いられている薬剤が腎臓の病態に与える影響についても解析を進めています。
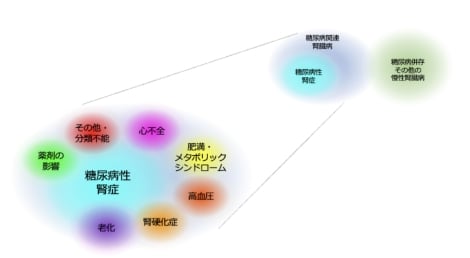
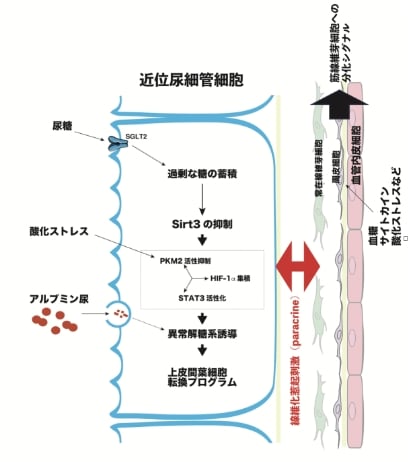
分子機構の検討では、尿細管細胞の異常な糖代謝が誘導する尿細管細胞―間質細胞転換(EMT)、線維化の惹起、細胞老化の意義、さらに尿細管細胞から周辺細胞へのパラクライン(paracrine)による作用機序を解析しています。また、血管内皮細胞が種々の障害に応答して、血管内皮細胞―間質細胞転換(EndMT)を介し線維化を誘導すること、さらにEMTとEndMTが相互作用することも明らかにしています(図2)。これらの詳細な分子機構については、シングルセル解析などの最新技術を用いて研究を進めています。
細胞老化の制御と糖代謝の関連
酸化ストレスや細胞外アシドーシス、特定のホルモン異常が尿細管細胞の老化を誘導することを見出しました。その中でも、解糖系の律速酵素であるpyruvate kinase muscle isoform 2(PKM2)の機能不全が重要な役割を果たしていることに着目し、新規薬剤の開発に取り組んでいます。
異常解糖系の抑制やPKM2を活性化する薬剤を用いることで、1型および2型糖尿病モデル動物の腎臓線維化を抑制できることを報告しました(図2)。この研究成果は、糖尿病関連腎臓病に対する新たな治療戦略の基盤となると期待されます。
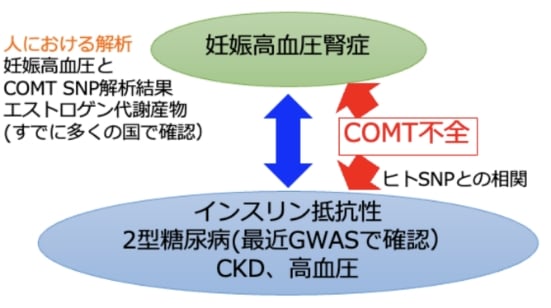
カテコール代謝不全の病態的意義
生体内には、カテコールアミンを代表とするカテコール(ベンゼン環のオルト位に2つの-OH基を持つ化合物)が存在します。お茶で知られるカテキンや、ブルーベリーに含まれるアントシアニンといったポリフェノールもカテコール構造を持ちます。
このカテコールを代謝する酵素であるカテコール-o-メチル基転移酵素(COMT)に着目した研究を進めています。金﨑はこれまでに、COMTの機能不全が妊娠高血圧腎症、塩分感受性高血圧、代謝異常など多様な腎障害や関連する病態を引き起こす可能性を報告しています。この研究は、腎疾患の新たな予防法や治療法の開発に繋がることが期待されます。
それぞれ最近・主な論文など
- Srivastava, S. P., Kanasaki, K. et al. Renal Angptl4 is a key fibrogenic molecule in progressive diabetic kidney disease. Sci Adv 10, eadn6068 (2024). https://doi.org/10.1126/sciadv.adn6068
- Kanasaki, K., Ueki, K. & Nangaku, M. Diabetic kidney disease: the kidney disease relevant to individuals with diabetes. Clin Exp Nephrol (2024). https://doi.org/10.1007/s10157-024-02537-z
- Kanasaki, K., Nangaku, M. & Ueki, K. ‘DKD’ as the kidney disease relevant to individuals with diabetes. Diabetol Int 15, 673-676 (2024). https://doi.org/10.1007/s13340-024-00747-0
- Kanasaki, K. The aberrant glycolysis in kidney proximal tubule: potential therapeutic target for DKD. Kidney Int 104, 1056-1059 (2023). https://doi.org/10.1016/j.kint.2023.09.019
- Srivastava, S. P. , Kanasaki, K. et al. Loss of endothelial glucocorticoid receptor accelerates diabetic nephropathy. Nat Commun 12, 2368 (2021). https://doi.org/10.1038/s41467-021-22617-y
- Srivastava, S. P. , Kanasaki, K. et al. Endothelial SIRT3 regulates myofibroblast metabolic shifts in diabetic kidneys. iScience 24, 102390 (2021). https://doi.org/10.1016/j.isci.2021.102390
- Takagaki, Y. , Kanasaki, K. et al. Endothelial autophagy deficiency induces IL6 – dependent endothelial mesenchymal transition and organ fibrosis. Autophagy 16, 1905-1914 (2020). https://doi.org/10.1080/15548627.2020.1713641
- Mizunuma, Y. , Kanasaki, K. et al. CD-1(db/db) mice: A novel type 2 diabetic mouse model with progressive kidney fibrosis. J Diabetes Investig 11, 1470-1481 (2020). https://doi.org/10.1111/jdi.13311
- Liu, H., Takagaki, Y., Kumagai, A., Kanasaki, K. & Koya, D. The PKM2 activator TEPP-46 suppresses kidney fibrosis via inhibition of the EMT program and aberrant glycolysis associated with suppression of HIF-1alpha accumulation. J Diabetes Investig 12, 697-709 (2021). https://doi.org/10.1111/jdi.13478
- Srivastava, S. P., Goodwin, J. E., Kanasaki, K. & Koya, D. Metabolic reprogramming by N-acetyl-seryl-aspartyl-lysyl-proline protects against diabetic kidney disease. Br J Pharmacol 177, 3691-3711 (2020). https://doi.org/10.1111/bph.15087
- Morita, M. & Kanasaki, K. Sodium-glucose cotransporter-2 inhibitors for diabetic kidney disease: Targeting Warburg effects in proximal tubular cells. Diabetes Metab 46, 353-361 (2020). https://doi.org/10.1016/j.diabet.2020.06.005
- Li, J., Kanasaki, K. et al. Renal protective effects of empagliflozin via inhibition of EMT and aberrant glycolysis in proximal tubules. JCI Insight 5 (2020). https://doi.org/10.1172/jci.insight.129034
- Srivastava, S. P., Kanasaki, K. et al. SIRT3 deficiency leads to induction of abnormal glycolysis in diabetic kidney with fibrosis. Cell Death Dis 9, 997 (2018). https://doi.org/10.1038/s41419-018-1057-0
- Kumagai, A., Kanasaki, K. et al. Dietary Magnesium Insufficiency Induces Salt-Sensitive Hypertension in Mice Associated With Reduced Kidney Catechol-O-Methyl Transferase Activity. Hypertension 78, 138-150 (2021). https://doi.org/10.1161/HYPERTENSIONAHA.120.16377
- Parchem, J. G., Kanasaki, K. et al. Loss of placental growth factor ameliorates maternal hypertension and preeclampsia in mice. J Clin Invest 128, 5008-5017 (2018). https://doi.org/10.1172/JCI99026
- Ueki, N., Kanasaki, K., Kanasaki, M., Takeda, S. & Koya, D. Catechol-O-Methyltransferase Deficiency Leads to Hypersensitivity of the Pressor Response Against Angiotensin II. Hypertension 69, 1156-1164 (2017). https://doi.org/10.1161/HYPERTENSIONAHA.117.09247
- Kanasaki, M., Kanasaki, K. et al. Deficiency in catechol-o-methyltransferase is linked to a disruption of glucose homeostasis in mice. Sci Rep 7, 7927 (2017). https://doi.org/10.1038/s41598-017-08513-w
- Shenoy, V., Kanasaki, K. & Kalluri, R. Pre-eclampsia: connecting angiogenic and metabolic pathways. Trends Endocrinol Metab 21, 529-536 (2010).
- Lee, S. B., Kanasaki, K. et al. Preeclampsia: 2-methoxyestradiol induces cytotrophoblast invasion and vascular development specifically under hypoxic conditions. Am J Pathol 176, 710-720 (2010).
- Kanasaki, K. et al. Deficiency in catechol-O-methyltransferase and 2-methoxyoestradiol is associated with pre-eclampsia. Nature 453, 1117-1121 (2008). https://doi.org/10.1038/nature06951

